NEWS CENTER
新闻中心
TG(谷氨酰胺转氨酶)简介
一、产品概述
谷氨酰胺转氨酶,简称TG酶,在自然界中广泛存在于人体、高级动物、植物和微生物中,它是一种酰基转移酶,可以催化同种或不同蛋白质分子之间的交联与聚合从而改善和提升食品蛋白质的性能,如乳化性、凝胶性、粘性和热稳定性等。
二、产品作用机理
1.粘合力极强:用TG催化形成的共价健在一般的非酶催化条件下很难断裂,所以用TG处理碎肉成形后,经冷冻、切片、烹饪处理均不会散开。
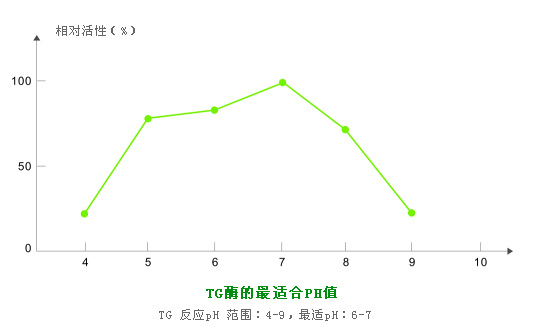
2.pH稳定性很好:TG的最适作用pH为6.0,但在pH5.0~8.0的范围内TG仍具有较高的活性。
3.热稳定性强:TG的最适温度在50℃左右,在45-55℃范围内都有较高的活性。特别是在蛋白质食品体系中,TG的热稳定性会显著提高,这一特性使其在一般的食品加工过程中,不至迅速失活。
4.TG在催化蛋白质反应过程中,温度(在保持酶活温度内)与时间成负相关关系:反应温度高,反应时间短;反之,温度越低时间越长。不同类型视频的理化特性,决定反应过程中温度和时间的关系。
5.使用安全:由于TG广泛存在于动物组织,人们一直在食用含有TG催化形成的(-谷氨酰)赖氨酸异肽键的食物,因此,用TG生产的食品不仅对人体安全,还有利于人体的健康。

三、产品特性

四、TG 作用时间、温度、pH
酶制剂催化食品加工过程中的各种化学反应,特点是用量少、催化效率高、专一性强。酶的作用受温度、时间影响很大,温度高时相对需要的反应时间就会大大缩短,温度低时,反应速率比较低,甚至还会不反应。
TG 需要的作用时间和温度是由催化食品的加工工艺、食品最终想要表现出来的物理特性的改善来决定的。当反应温度升高时,时间会大大减少,在一定范围内温度越高,反应速率越大。当温度继续升高,TG 酶开始失活,并且温度越高,需要的失活时间越短。
五、酶的命名与分类
1. 酶的命名
(1) 习惯命名法 1、根据其催化底物来命名;2、根据所催化反应的性质来命名; 3、结合上述两个原则来命名, 4、有时在这些命名基础上加上酶的来源或其它特点。
(2) 国际系统命名法 系统名称包括底物名称、构型、反应性质,最后加一个酶字 例如:习惯名称:谷丙转氨酶 系统名称:丙氨酸:α-酮戊二酸氨基转移酶 酶催化的反应:谷氨酸+丙酮酸→α-酮戊二酸+丙氨酸
2. 酶的分类
(1) 水解酶 hydrolase 水解酶催化底物的加水分解反应。主要包括淀粉酶、蛋白酶、核酸酶及脂酶等。例如,脂肪酶(Lipase)催化的脂的水解反应:R-COOCH2CH3→RCOOH+ CH3CH2OH
(2) 氧化-还原酶 Oxidoreductase 氧化-还原酶催化氧化-还原反应。主要包括脱氢酶(dehydrogenase)和氧化酶(Oxidase)。 如,乳酸(Lactate)脱氢酶催化乳酸的脱氢反应。
(3) 转移酶 Transferase 转移酶催化基团转移反应,即将一个底物分子的基团或原子转移到另 一个底物的分子上。例如,谷丙转氨酶催化的氨基转移反应。
(4) 裂合酶Lyase裂合酶催化从底物分子中移去一个基团或原子形成双键的反应及其逆反应。主要包括醛缩酶、水化酶及脱氨酶等。例如,延胡索酸水合酶催化的反应。
(5) 异构酶 Isomerase 异构酶催化各种同分异构体的相互转化,即底物分子内基团或原子的 重排过程。例如,6-磷酸葡萄糖异构酶催化的反应。
(6) 合成酶 Ligase or Synthetase合成酶,又称为连接酶,能够催化 C-C、C-O、C-N 以及 C-S 键的形成反应。这类反应必须与ATP分解反应相互偶联。 A + B + ATP + H-O-H ===A ?B + ADP +Pi 例如,丙酮酸羧化酶催化的反应。丙酮酸 + CO2→草酰乙酸
(7) 核酸酶(催化核酸)ribozyme 核酸酶是唯一的非蛋白酶。它是一类特殊的 RNA,能够催化 RNA分子中的磷酸酯键的水解及其逆反应 ◆辅酶 辅酶 coenzyme coenzyme 和金属离子 根据酶的组成情况,可以将酶分为两大类:单纯蛋白酶 它们的组成为单一蛋白质。结合蛋白酶某些酶,例如氧化- -还原酶等,其分子中除了蛋白质外,还含有非蛋白组分。结合蛋白酶的蛋白质部分称为酶蛋白,非蛋白质部分包括辅酶及金属离子(或辅因子cofactor)。酶蛋白与辅助成分组成的完整分子称为全酶。单纯的酶蛋白无催化 功能起并协同实施催化作用,这类分子被称为辅酶(或辅基)。辅酶是一类具有特殊化学结构和功能的化学结构和功能的化合物。参与的酶促反应主要为氧化还原反还或基团转移反应。大多数辅酶的前体主要是水溶性 B 族维生素。许多维生素的生理功能与辅酶的作用密切相关。
六、维生素与辅酶
维生素是机体维持正常生命活动所必不可少的一类有机物质。 分为脂溶性和水溶性两大类,其中脂溶性维生素在体内可直接参与代谢的调节作用,水溶性维生素是通过转变成辅酶对代谢起调节作用。
七、 酶的结构及催化作用机制
(一)酶分子的结构特点 1、结合部位 Binding site 酶分子中与底物结合的部位或区域一般称为结合部位。 结合部位决定酶的专一性; 2、催化部位 catalytic site 酶分子中促使底物发生化学变化的部位称为催化部位。通常将酶的结合部位和催化部位总称为酶的活性部位或活性中心。 活性中心。催化部位决定酶所催化反应的性质;3、调控部位 Regulatory site 酶分子中存在着一些可以与其他分子发生某种程度的结合的部位,从而引起酶分子空间构象的变化,对酶起激活或抑制作用。
(二)酶活性中心及酶活性中心的必需基团 主要包括: 亲核性基团:丝氨酸的羟基,半胱氨酸的巯基和组氨酸的咪唑基;酸碱性基团:门冬氨酸和谷氨酸的羧基,赖氨酸的氨基,酪氨酸的酚 羟基等。
(三)酶活性中心的测定方法 P134-135 分子水平研究酶作用机制,对酶进行模拟或调控的基础。 ① 切除法 用专一水解酶切除酶分子肽链中的部分,测其余部分的活 性,其余部分有活性那么该切除部分并非活性中心,继续进行切 除测定,反之则是活性中心。transglutaminase ② 化学修饰法 ③ X 射线衍射法 ④ 基因定点突变技术
(四)酶与底物分子的相互作用 135-136 1、酶与底物分子间的作用力 静电引力 氢键 疏水键 2、酶与底物分子相互作用的形式 邻近效应和定向效应 136 与反应过渡态的结合作用 好的底物不一定与酶有很好的亲和力但是 其过渡态一定与酶有很强的结合能力 (共价结合 非共价结合); 3、多功能催化作用 酶活中心一般有多个催化基团;4、酶催化作用学说 锁钥理论 诱导契合学说 手性催化作用机制 锁钥学说认为整个酶分子的天然构象是具有刚性结构的,酶表面具有特定的形 状。酶与底物的结合如同一把钥匙对一把锁一样科学家后来发现,当底物与酶结合时,酶分子上的某些基团常常发生明显的变化。另外,酶常常能够催化同一个生化反应中正逆两个方向的反应。因此,“锁和钥匙学说”把酶的结构看成是固定不变的,这是不符合实际 的。诱导契合学说认为酶表面并没有一种与底物互补的固定形状, 而只是由于底物的诱 导才形成了互补形状,三点结合的催化理论认为酶与底物的结合处至少有三个点, 而且只有一种情况是完全结合 的形式。只有这种情况下,不对称催化作用才能实现。







